
検査内容変更のお知らせ
謹啓 時下ますますご清栄のこととお喜び申し上げます。
平素は格別のご高配を賜り厚くお礼申し上げます。
このたび、下記の検査項目について、検査内容を変更させていただきたくご案内いたします。
何卒ご了承賜りますよう、よろしくお願い申し上げます。
敬白
記
■実施日 平成29年 7月 6日(木) ご依頼分より
■変更項目
※平成29年6月26日ご依頼分より
詳細については下記をご覧ください。
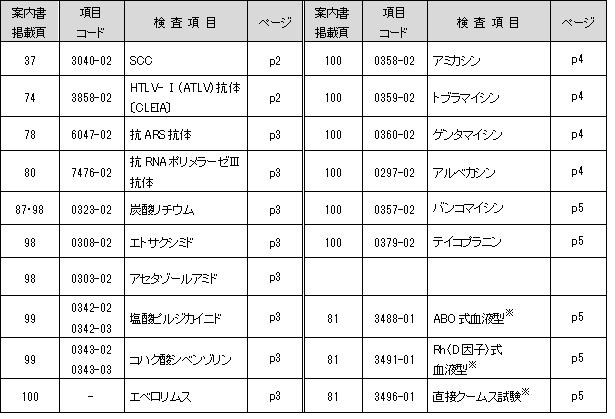
SCC
癌組織で有意に上昇すると言われているSCCA2に対する反応性の高い試薬が発売されましたので、
測定試薬が変更となります。
これに伴い、検査方法・基準範囲・報告範囲が変更となります。
新基準範囲はメーカー設定値です。
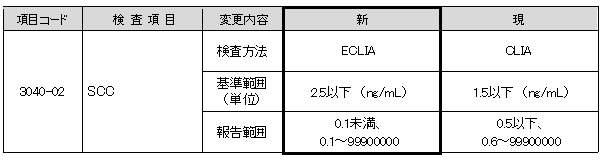
▼現法と新法の比較
HTLV-Ⅰ(ATLV)抗体〔CLEIA〕
現試薬の発売中止に伴い、測定試薬が変更となります。
これに伴い、項目コード、備考が変更となります。
新試薬はHTLV-ⅠおよびHTLV-Ⅱの両方を測定対象としますが、型別の報告はできません。
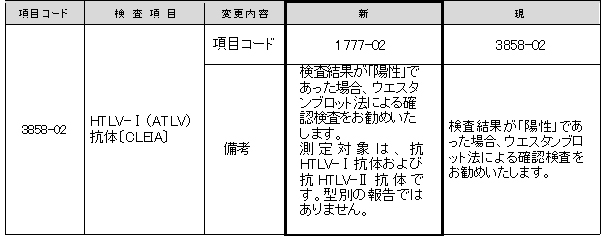
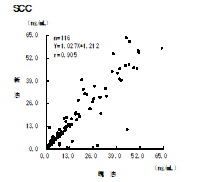
▼現試薬と新試薬の比較
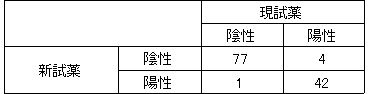
判定一致率:96.0%(n=124)
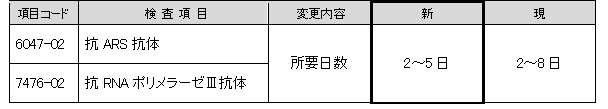
抗ARS抗体、抗RNAポリメラーゼⅢ抗体
下記項目におきまして所要日数が短縮となります。
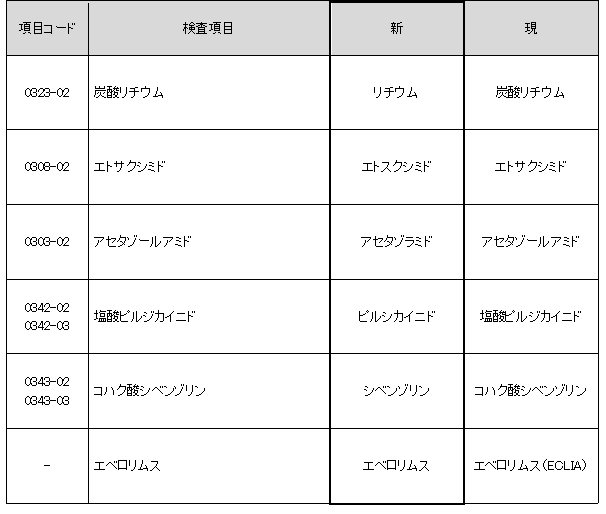
報告書名称変更
より適切な名称に変更となります。
アミカシンほか薬物6項目(下記一覧参照)
抗菌薬TDMガイドライン2016に準拠した基準範囲、採血時刻が変更となります。
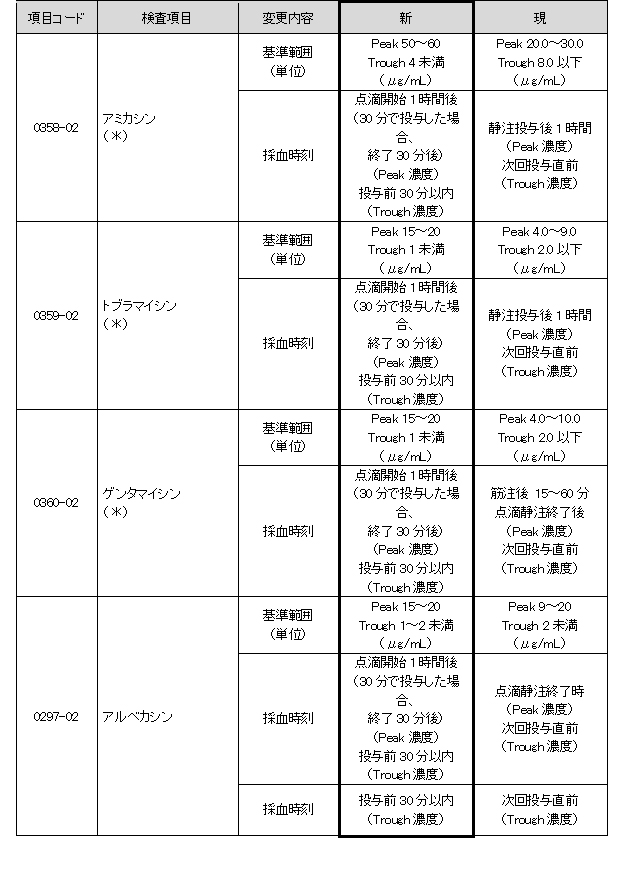
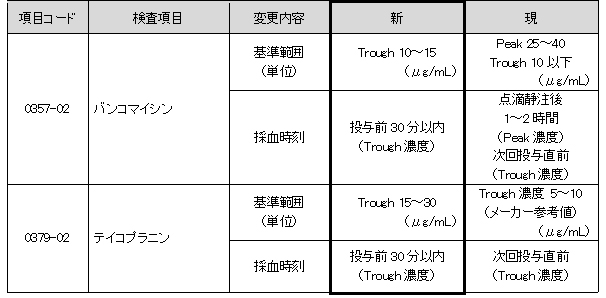
(*)アミカシン・トブラマイシン・ゲンタマイシンの新基準範囲は、グラム陰性菌感染症の重症時における標準治療の基準です。
検査方法変更 (平成29年6月26日依頼分より)
輸血検査機器導入に伴い、方法および採取容器が変更となります。
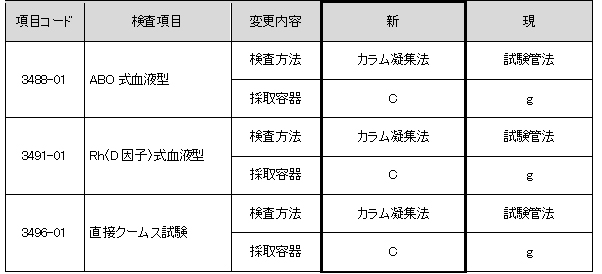
※インフォメーションNO.2017-24 案内参照


